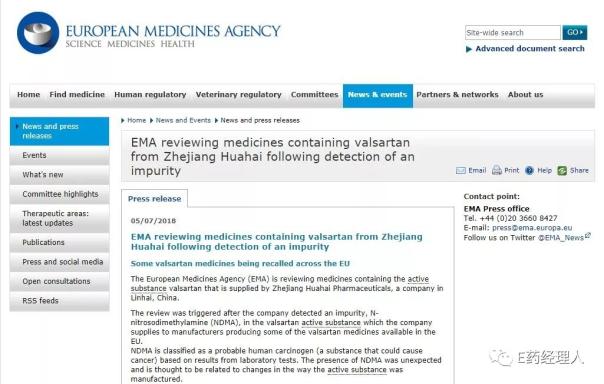
2018年7月5日,欧洲药品管理局(EMA)发出通告:因检测出杂质,EMA正在评估以浙江华海生产的缬沙坦原料药的药品,部分缬沙坦药品正在欧盟进行召回。检测出的杂质为亚硝基二甲胺(NDMA),在2017年10月27日世界卫生组织国际癌症研究机构公布的致癌物清单中属于2A类致癌物。
7月7日,华海发布《浙江华海药业股份有限公司关于缬沙坦原料药的未知杂质中发现极微量基因毒性杂质的公告》。公告表示,据华海了解的情况,EMA发布了召回公告后,德国、意大利、芬兰、奥地利、日本等多个国家药监部门相继发布召回公告。
被视为中国本土药企出海第一家的华海药业,在缬沙坦原料药被检测出致癌物质而召回的消息一经报道,立刻在国内引起巨大关注。华海缬沙坦原料药2017年在欧洲的销售额为3.28亿元。中财网数据显示,截至7月9日下午3点,华海股价下跌9.99%。
E药经理人在今天下午致电华海药业副总裁兼董事会秘书祝永华采访相关情况,对方表示:
此次发现部分华海缬沙坦原料药存在NDMA杂质为华海自己发现,并主动上报给EMA等监管方,并非意外。此次发现的杂志问题不会影响华海在国内已获批并视为通过一致性评价的缬沙坦片,因为产品刚刚获批不久,还未上市。
7月9日下午两点,华海药业在上交所官方交流平台召开“关于缬沙坦原料药的未知杂质中发现极微量基因毒性杂质事项的投资者说明会”。综合所有问题,投资者最关心的问题只有一个:此次因杂质问题所引发的召回事件,会给华海业绩具体造成哪些影响?
以下为部分提问摘录:
Q:请问此事件是否对华海半年业绩造成影响?
A:目前尚无法准确评估此事件对当期业绩的影响。缬沙坦暂停发货会对半年度原料药的销售产生一定的影响。
Q:请问销往北美、南美、印度、俄罗斯的缬沙坦产品目前是否主动暂停供应?本次事件是否有可能产生赔偿性的支出?
A:目前公司主动暂停市场供应,等待各官方的调查结果。本次事件有可能会涉及赔偿要求,具体视与客户签订的供应协议、质量协议和其他相关交易文件协商而定。
Q:更改工艺这事欧盟和fda是不是知道的,是不是重新认证过的?下一步公司是否面临美国召回的问题?希望公司高管们能够适当的增持,用行动表明信心。
A:公司的工艺变更均进行了申报并获得官方批准,目前公司正与美国FDA就相关技术标准进行讨论,公司目前尚未知是否会面临美国召回的问题。公司非常关注股价的波动,公司将会采取积极的措施,努力将事件的影响降到最低。
Q:请问销往北美、南美、印度、俄罗斯的缬沙坦产品目前是否主动暂停供应?本次事件是否有可能产生赔偿性的支出?
A:目前公司主动暂停市场供应,等待各官方的调查结果。本次事件有可能会涉及赔偿要求,具体视与客户签订的供应协议、质量协议和其他相关交易文件协商而定。
Q:此事件中,公司面临的损失有哪些?
A:从直接损失的角度,公司可能面临客户退换货的损失,以及制剂厂商因召回所要承担的附带责任。目前公司正积极与客户进行协商,根据客户对其制剂召回的情形、制剂及原料药的库存量等作出有效的判断,并根据与客户签订的供应协议、质量协议和其他相关交易文件,协商解决方案,以将损失降到最低。
Q:请问你司的制剂产销情况如何,会不会也可能出现毒性杂质情况?
A:由于工艺情况不同,除缬沙坦外,公司其他产品不存在检出该基因毒性杂质情况。
 客服热线:
客服热线:












