近期,GBI Health发布《2017年新药审评总结》报告,报告数据显示,2017年进口药获批数量达到39个,国产1类新药申报数174个,均创下近10年之最。中国创新药获批数量即将迎来井喷之年。
进口化药和生物药创十年之最
2016年1月底,CDE开始实施优先审评制度以来,众多跨国药企的创新药纷纷进入优先审评程序,进口药在中国的上市速度大大提升。GBI SOURCE数据显示,2017年共有34个进口化药首次在中国注册,数量达到了近十年之最。其中,23个产品是通过优先审批流程获批。
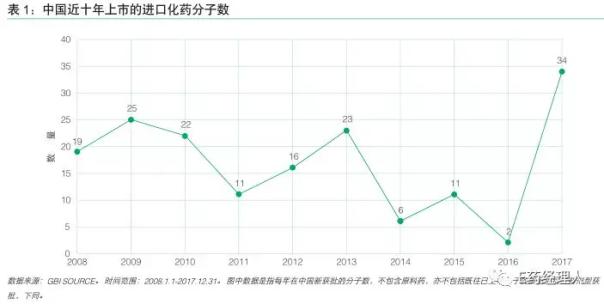
从时间上来看,这34个药物在中国获批时间与国际上首次获批时间间隔的平均值为5.3年。最快的是阿斯利康治疗非小细胞肺癌的药物泰瑞沙,间隔时间仅为1年5个月。而更具代表性的是,泰瑞沙从获批到上市销售历时不到一个月,创下了历史最快速度。
众所周知,此前由于进口药进入临床二期才能在国内提交申请、国内知识产权保护不完善、审批人员不足等种种原因,进口药在国内上市缓慢,一般都会面临5年或更长时间。最具代表性的例子之一是葛兰素史克的宫颈癌疫苗希瑞适,国际上获批之后,历时10年才被CFDA批准上市。而获批仅仅意味着走完了上市一半的路程,获批后,通常还要半年到一年的时间才能将药物推向市场。这足以表明,CFDA要解决进口药在中国上市缓慢这一历史难题的决心和努力的成效。
从企业分布来看,各大制药巨头基本都有化学药物在2017年获批。数量最多的是前三名分别是勃林格殷格翰、诺华制药、阿斯利康和强生。
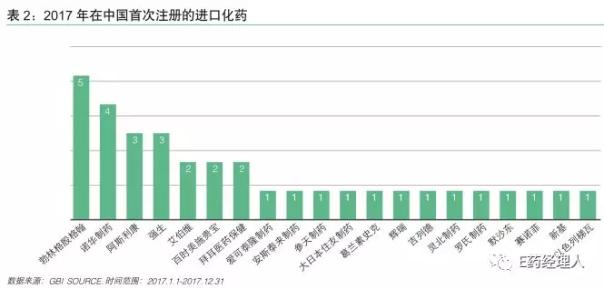
对这些跨国药企更为利好的消息是,其产品获批后不就便被部分地区纳入医保范围。2017年12月,诺华的芦可替尼和培唑帕尼、阿斯利康的奥西替尼、强生的伊布替尼、BMS的达拉他韦/阿舒瑞韦、罗氏的维莫非尼均被浙江省纳入大病医保范围。诺华的沙库巴曲/缬沙坦、BMS的达拉他韦/阿舒瑞韦还在2018年1月被吉林省纳入该省的乙类医保目录。泰瑞沙也在产品生命周期的早期被部分地区纳入医保。阿斯利康CEO Soriot在2017年第四季度电话会议中表示:“这是5年前不可能发生的事情。”
与化药相比,生物药起步较晚,中国市场上的生物药主要以进口药为主。GBI SOURCE数据显示,2008~2016年间,共有20款进口生物药在国内获批上市,2017年,有5个进口生物药首次在中国获批,数量亦达到了近十年来的最高值。
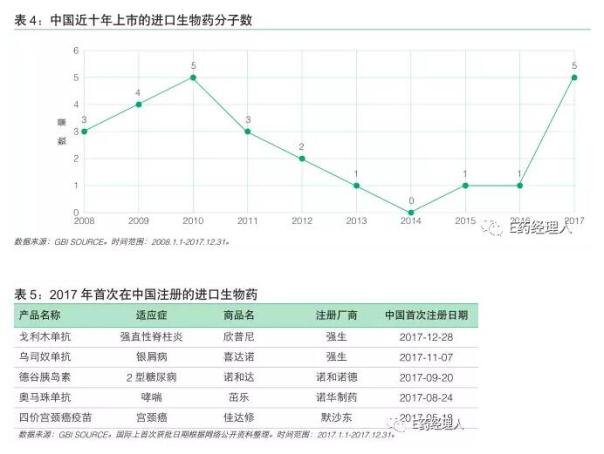
从时间上看,除了诺和诺德的糖尿病治疗药物德谷胰岛素国内外上市时间间隔3年之外,其余4款药物在我国上市均比国外滞后了8年以上。尤其是诺华的哮喘药奥马珠单抗,最早2002年在澳大利亚上市,2017年8月在中国获批,相隔了整整15年。如何提高生物创新药在国内的上市进程,仍然是一个亟待解决的问题。
国产1类创新药申报数创10年之最
我国制药企业中大部分以仿制药为主,真正拥有创新药研发能力的企业不多。GBI SOURCE数据显示,2008~2017年的十年间,获批上市的1.1类化药和1类生物药(2007注册分类)仅有十余个。
在一系列新药研发政策鼓励下,中国的创新药研发能力已经取得了很大进步。这一点可以从国内企业近年来1类创新药的申报数目上得到印证。
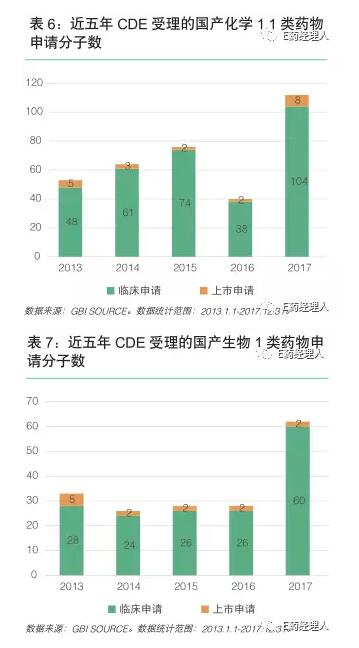
GBI SOURCE数据显示,近5年来,CDE手里的国产1.1类化药分子数目除了在2016年有所下降外,其他年份均呈上升趋势。2017年申报数目为112个,包括临床申请和上市申请,达到十年之最。生物药申报数量62个,是2016年的2倍多。2017年,由中国军事医学科学院和天津康希诺生物股份有限公司合作开发的重组埃博拉病毒疫苗获批,这是预防性生物1类新药。
创新药井喷
2017年10月,CFDA发布《关于调整进口药品注册管理有关事项的决定》,取消阻碍进口药在华上市进程的一系列关卡,允许进口药(预防用生物制品除外)在中国境内外同步开展I期临床试验,取消开展国际多中心药物临床试验(MRCT)的药品此前的“三报三批”流程和部分进口药品在境外上市的要求,允许进口药直接在中国提出进口上市注册申请。
这些政策措施,无疑将进一步加速进口药在华上市速度。
此外,为了解决临床急需药品短缺问题,CFDA在2017年12月底发布《临床急需药品有条件批准上市的技术指南(征求意见稿)》,提出允许境外已批准上市的罕见病治疗药品、早期或中期临床试验数据显示有明显治疗优势的药品在中国有条件批准上市,这对制药企业来说无疑是极大的利好消息。
而在2017年,已经有几个产品享受到了该政策的优惠。上述提到的重组埃博拉病毒病疫苗即是通过有条件批准上市。恒瑞的乳腺癌治疗药物马来酸吡咯替尼、信达生物的PD-1单抗信迪单抗,均是基于Ⅱ期临床试验数据向CFDA递交新药上市申请。
此外,《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中还提出,探索建立药品审评审批与药品专利链接制度,开展药品专利期限补偿制度试点;完善医保目录动态调整机制、建立医保支付标准谈判机制,及时按规定将新药纳入基本医疗保险支付范围等。这些政策措施将进一步鼓励制药企业新药研发热情,加速创新药在中国的上市速度。
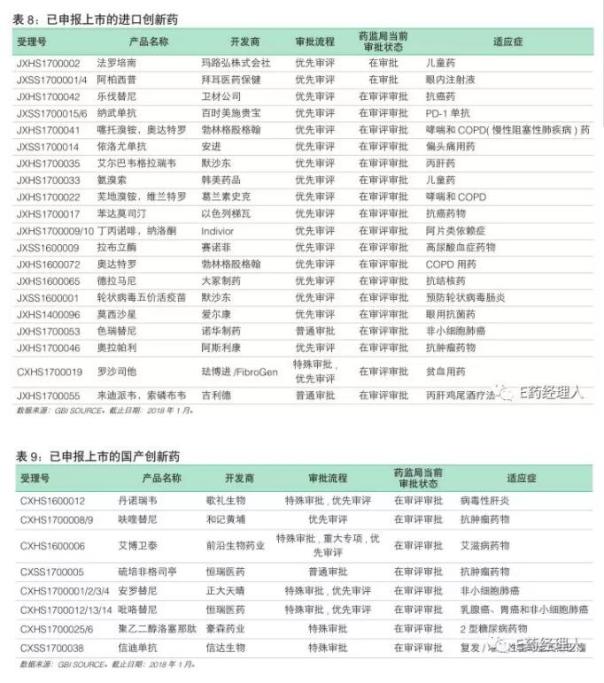
未来几年,中国每年获批的创新药数量将呈现井喷之势。截止2018年1月底,已有20个进口创新药、8个国产创新药在中国递交首次上市申请,大部分已经被纳入优先审评、特殊审评流程。这28个创新药中不乏重磅炸弹级别的药物。
 客服热线:
客服热线:












