与过去几年相比,2017年全球单克隆抗体药物领域热度依然不减:截至2017年12月31日,FDA和EMA共批准单克隆抗体药物10个,全球主流市场获批的单克隆抗体类药物(包含获批之后因各种原因撤市的药物,不包含Fc融合蛋白)累计已达73个;临床阶段、新的项目源源不断往前推进,新的靶点和新的技术正在进行概念验证,这些概念的逐步验证将使得单克隆抗体药物拥有更大的应用潜力。
可以说,我们正经历单克隆抗体药物发展的黄金时期。在此新旧年交替之际,笔者尝试梳理单克隆抗体药物在2017年里的市场状况和研发情况,并对已经开始的新的一年做一个展望。
二十余年大数据:全球获批数量累计73个
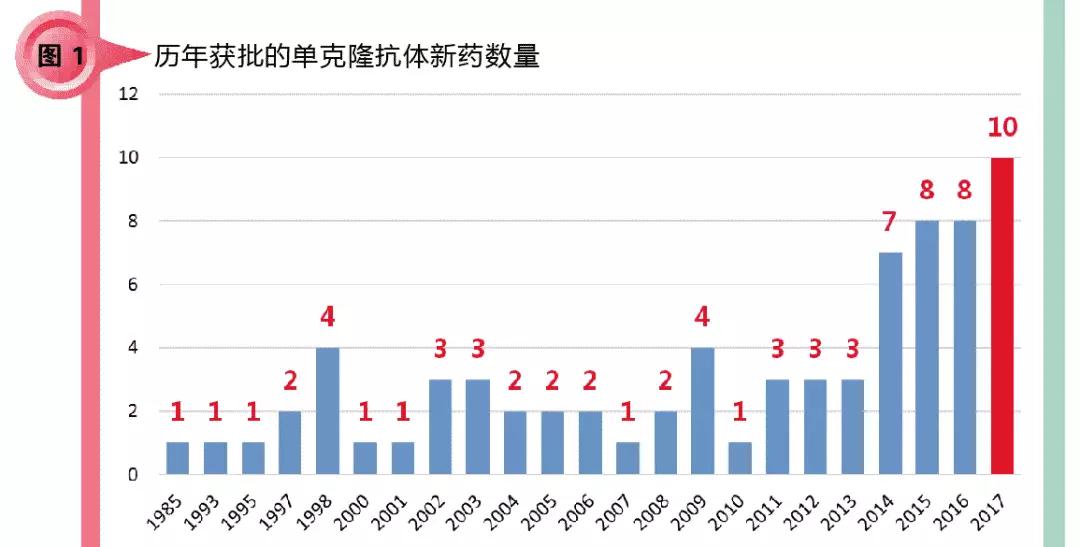
笔者对全球主流市场获批单克隆抗体新药进行了汇总(见图1)。可以看到,获批的单克隆抗体药物数目总计已达73个。一年内获批抗体数目从2014年开始有了一个较大的增加,后面3年稳中有升。单克隆抗体药物研发已经从早期的零敲碎打阶段步入大规模的研发时期。2017年全年,全球主流市场获批单克隆抗体新药10个,为历年最高。
对73个单克隆抗体药进行分类,从适应症分布来看,以癌症(包括血液系统癌症和非血液系统癌症)和免疫疾病(包括自身免疫疾病和外因导致的炎症)为主,针对这两个疾病领域的抗体共有60个,占总数的82.2%;感染、心血管疾病也有涉及,共有7个抗体;另有6个抗体用于治疗骨科疾病、眼科疾病、罕见病等数量较少。
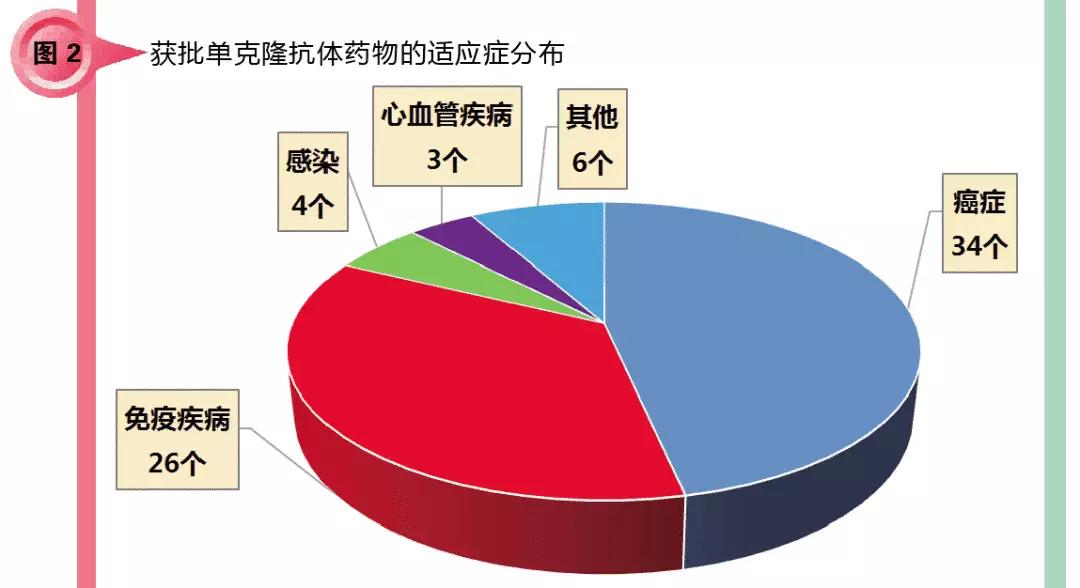
适应症以癌症和免疫疾病为主的原因,一是因为患者基数大、细分市场众多,二是这两类疾病相关机理的研究较为成熟,且药物靶点适合开发单克隆抗体药物。其他领域占比相对较小。但笔者相信,随着基础研究的深入、临床试验的突破等,单克隆抗体药物对癌症和免疫疾病以外的其他领域的渗透会越来越多。
2017年获批药物:10个创历年新高,且不乏亮点
2017年获批的10个单克隆抗体药物的基本信息如表1。

赛诺菲和再生元合作开发的Sarilumab(Kevzara)为靶向白介素6受体的单克隆抗体,2017年5月获FDA批准,6月获EMA批准,用于中度至重度类风湿性关节炎的二线治疗。2016年与阿达木单抗的头对头Ⅲ期临床研究SARIL-RA-MONARCH的结果显示,Sarilumab的治疗效果优于阿达木单抗,这意味着阿达木单抗可能会遭遇强有力的竞争。
默克和辉瑞合作开发的Avelumab(Bavencio)和阿斯利康的Durvalumab(Imfinzi)均为靶向PD-L1的单克隆抗体,它们的获批和上市使得上市的PD-1/PD-L1抗体增加至5个,肿瘤免疫市场的竞争进一步激烈。
辉瑞的Inotuzumabozogamicin(Besponsa)是抗体药物偶联物(ADC),通过抗体的靶向性使小分子毒物能够精确杀伤高表达CD22的癌细胞。该药于2017年6月获欧盟批准上市,是第4个获批的ADC,它的获批使得人们对这一类药物研发的信心得以提高。
罗氏的Emicizumab(Hemlibra)是2017年最后一个获批的单克隆抗体药物,它靶向凝血因子Ⅸa和Ⅹ,促进Ⅸa和Ⅹ的结合,从而促进凝血过程。Emicizumab的上市,能够帮助A型血友病患者减少用药频率,提高生活质量。同时,该药物也是双特异性抗体在非癌症领域的第一次获批。
可见,这一年获批的单克隆抗体药物不仅数量提高,而且不乏亮点。
临床后期项目:适应症“两大类”格局有所变化
从笔者检索到的信息来看,截至2017年12月31日,有近60个抗体新药处在临床Ⅲ期研究阶段。从适应症的分布来看,虽然癌症和免疫疾病两大类仍然占据多数,但是其他疾病领域的研发项目比例有所提高,其中最为明显的是神经系统疾病,主要是阿尔兹海默症和偏头痛。
阿尔兹海默症的治疗上已经多年没有新药上市,市场空间很大,如果有单克隆抗体药物获批,相关企业将会因填补市场空缺而获得巨大收益。不过,从目前的临床试验结果来看,似乎只有Biogen公司的Aducanumab有获批的希望。
偏头痛同样也是长期没有理想的治疗药物,市场空间很大。但与阿尔兹海默症不同的是,偏头痛相关研发管线进展顺利:安进的Erenumab(靶向CGRPR)、礼来的Galcanezumab(靶向CGRP)和梯瓦的Fremanezumab(靶向CGRP)已经提交上市申请,Alder的Eptinezumab(靶向CGRP)的Ⅲ期临床数据也是十分积极,公司也准备在2018年下半年递交新药申请。
其他疾病领域如眼科疾病、血液病等,制药企业也有了更多的布局。单克隆抗体药物研发向这些领域的渗透,既是得益于基础研究和靶点验证的深入,也是归因于越发复杂的商业竞争。
技术开发和应用:结构改造、筛选方法不断突破
单克隆抗体药物研发的技术层面的发展和应用,主要体现在两个方面:一是抗体结构的改造,二是新的抗体筛选方法。
结构改造方面,笔者总结有3类:双特异性抗体、抗体药物偶联物(ADC)和小型化抗体。
双特异性抗体大家已经不陌生,全世界有很多企业和实验室拥有形式各异的双特异性抗体平台,已经获批的双特异抗体药物也已经有3个:Catumaxomab、Blinatumomab和Emicizumab。早期双特异性抗体概念的提出,主要是针对癌症治疗,希望通过多靶点、多通路的抑制来提高药物杀伤癌细胞的效果;后来这一概念逐渐推广到免疫疾病、抗感染等其他疾病领域。不过,虽然在设计上可以尽情想象,但双特异性抗体的实际临床效果有待更多的验证,另外生产方面有很大的挑战,需要长期的摸索和优化。
ADC的技术核心主要是抗体与小分子药物之间的连接子的设计以及抗体上的连接位点的选择。经过长期的开发,基本问题已经解决,ADC技术已经逐渐步入大规模应用阶段。目前,临床Ⅲ期的在研ADC药物约有9个。
小型化抗体包括纳米抗体、小型的类抗体支架蛋白等。对这一类药物的开发,主要是为了改进标准结构的抗体的一些固有缺陷,包括筛选流程复杂、组织渗透性差、生产成本高等。目前,比利时的Ablynx公司在纳米抗体的研发方面处于绝对领先地位,通过自主研发和合作开发,它已经有多个项目进入临床阶段;其他的类抗体支架蛋白,如Affibody、DARPins等,也在概念验证的阶段。
筛选方法开发方面,主要是人源化小鼠的逐渐普及和基于单个B细胞的抗体筛选方法的逐步成熟。这两项技术都经历了较长时间的发展,目前已有通过人源化小鼠技术获得的单克隆抗体药物上市,但单个B细胞抗体筛选方法还未有产出,但它是一个明显的发展方向。
热门研发靶点:肿瘤免疫检查点抑制剂一枝独秀
基于免疫检查点抑制剂的肿瘤免疫疗法不再只停留在单药靶向性治疗的层面,而是已经成为一种治疗思想,即恢复或增强患者自身免疫系统的活力,利用免疫系统来杀伤癌细胞。
早期的开发主要是针对CTLA-4、PD-1、PD-L1等免疫检查点的单药治疗,通过阻止癌细胞对机体自身T细胞的抑制,恢复T细胞的肿瘤杀伤作用,取得了不错的效果。而现在,主流的研发思路是以这些免疫检查点抑制剂为中心,探索与其他药物联合治疗的方案。
多家企业正在基于PD-1/PD-L1抗体探索与上市的或在研的其他药物联合使用的可能性:默沙东为Keytruda设计了多种与小分子药物联合的治疗方案,以百时美施贵宝的Opdivo为基础的联合用药临床试验也多达数百个;礼来与信达、新基与百济神州的涉及PD-1抗体的商业合作,也能看出大型制药企业布局肿瘤免疫疗法、以期在未来的市场分得一杯羹的决心。
除了基于PD-1/PD-L1的联合用药之外,更多的免疫检查点正在成为抗体研发的热门靶点。Tim-3、LAG-3等靶点的单克隆抗体药物研发逐渐升温,更多类型、更多层次的联合用药正在被开发;在基础研究领域,免疫检查点的调控机制正不断被挖掘,肿瘤免疫的概念不断被深化。肿瘤免疫正在向系统化、精细化的方向迈进。
而随着2017年数个单药和联合用药的临床试验遭遇失败,医药行业对于肿瘤免疫的态度也逐渐回归理性。肿瘤免疫这一治疗思想很有前景,但人们需要很多时间去摸索和积累,才能真正理解。
中国迅速崛起:研发度逐渐处于国际前沿
2017年这一年里,国内共有5个单克隆抗体药物申报美国临床试验成功。至此,成功申报美国临床试验的国内单克隆抗体药物达到9个。

另外,百济神州、科伦药业、誉衡药业等企业先后将自身的免疫检查点抑制剂项目授权给国外企业。这些信息体现出,国内企业在单克隆抗体研发领域不仅渐出佳绩,而且研发实力得到了国际认可。
从各大企业的单克隆抗体药物研发管线和申报情况来看,研发布局集中在两个方面:
一个是经典药物的生物类似药研发,仿制对象集中于阿达木单抗(修美乐)、曲妥珠单抗(赫赛汀)、贝伐珠单抗(安维汀)、利妥昔单抗(美罗华)等重磅品种。生物类似药研发的最终落地点,是降低成本,继而降低药物价格,使患者的药物可及性得以提高。
另一个是免疫检查点抑制剂的开发。较为集中的仍然是PD-1/PD-L1的抗体研发,目前国内有超过10家企业拥有临床阶段的项目,还有多家企业的项目处在早期开发和临床申报的阶段。除了这两个靶点之外,Tim-3、LAG-3等靶点的研发国内也迅速跟进,誉衡药业与药明生物的再度合作,显示国内在肿瘤免疫领域的研发进度已逐渐处于国际前沿。
除此之外,也有部分企业布局ADC(如恒瑞)、双特异性抗体(如健能隆)等技术。可以看出,在做“me-too”的同时,越来越多企业开始尝试微小的创新。
展望2018:哪些新药将获批?有哪些新趋势?
笔者认为,2018年全球单克隆抗体领域的发展将沿着我们在2017年甚至更早就已经觉察到的趋势。适应症方面,癌症和免疫疾病之外的疾病领域会继续被开拓,单克隆抗体药物的应用前景进一步广阔;技术方面,双特异性抗体、抗体药物偶联物(ADC)和小型化抗体等主要的工程化改造技术将会被持续发展和应用,诸多新的分子设计将被尝试在临床试验中进行检验。
临床后期和处于上市申请阶段的药物中,笔者预计以下几个单克隆抗体药物会在2018年获批:
台湾中裕新药的TMB-355,一款靶向人类免疫缺陷病毒(HIV)的抗艾滋病抗体,目前已经在上市审评阶段。一旦获批,它将帮助患者克服传统抗病毒药物的耐药性问题。
治疗偏头痛的3个药物,即安进的Erenumab、礼来的Galcanezumab和梯瓦的Fremanezumab。相信在2018年,偏头痛领域将会从“没有有效治疗方法”一步跨越到“巨头竞争”的阶段。
Ablynx的Caplacizumab,用于治疗获得性血栓性血小板减少性紫癜。如果获批,它将是第一个获批的纳米抗体药物。
艾伯维的Rovalpituzumab tesirine,即靶向DLL4的ADC药物,有望用于治疗小细胞肺癌。一旦获批,它将是全球第5个获批的ADC药物。咨询机构evaluatePhama预计该药2022年销售额将达到2.39亿美元。
另外,礼来的Sirukumab、协和发酵麒麟的Burosumab等也有很大的获批希望。
至于国内单克隆抗体药物2018年的研发布局,在靶点方面,会继续向肿瘤免疫领域的“me-too”和“me-better”集中,其他经典靶点也会持续受到关注;在技术方面,ADC药物、双特异性抗体不会迅速成为主流,但是数量上会有所增加。整体而言,国内的新药研发会以“me-too”和“me-better”为主要目标,部分新兴药企会尝试比较大的技术创新;在经历早期的扎堆研发之后,相信更多企业会开始有意识地寻求差异化。




