行业立项现状究竟如何变化?为此,笔者对2017年上半年化学药生产申报情况的相关数据进行分析。2017年上半年,生产申服依然以化学药申报为主,没有中成药报产,也没有化学药新2类报产。
新1类:2个替尼
新1类(化药1类新药)有2个报产,2个都是替尼类,分别为正大天晴药业集团股份有限公司和南京爱德程宁欣药物研发有限公司申报的盐酸安罗替尼胶囊,以及和记黄埔医药(上海)有限公司申报的呋喹替尼胶囊。另外,生物药还有1个1类新药,为康希诺生物股份公司和中国人民解放军军事医学科学院生物工程研究所共同申报的重组埃博拉病毒病疫苗。
盐酸安罗替尼胶囊此前已启动的临床项目适应症包括晚期非小细胞肺癌、小细胞肺癌,晚期甲状腺髓样癌、分化型甲状腺癌,以及晚期软组织肉瘤、结直肠癌、晚期肾细胞癌、软组织肉瘤、晚期胃癌、晚期胃食管结合部腺癌、食管鳞癌。盐酸安罗替尼胶囊以与现有治疗手段相比具有明显治疗优势和重大专项为由被纳入优先审评品种名单。
重组埃博拉病毒病疫苗同样以创新药注册申请和重大专项被纳入优先审评品种名单。呋喹替尼胶囊暂未申报优先审评,呋喹替尼胶囊已启动的临床项目适应症包括结直肠肿瘤(CRC)、实体恶性肿瘤、非小细胞肺癌和晚期胃癌。
新3类:以注射剂为主
化学药新三类以原料药和注射剂申报为主。
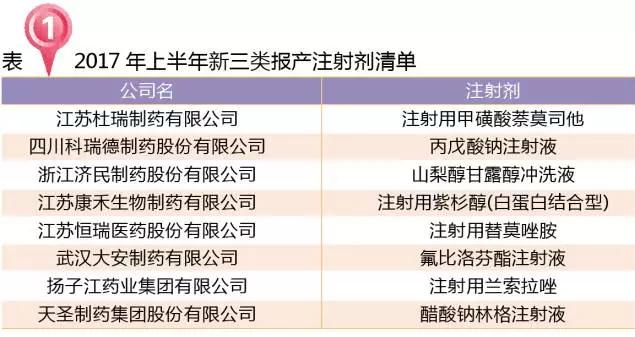
注射用紫杉醇(白蛋白结合型)是近几年比较热的产品,2016年后申报生产的厂家有石药集团欧意药业有限公司、江苏康禾生物制药有限公司和江苏恒瑞医药股份有限公司。2017年江苏恒瑞医药股份有限公司以旧6类报产。石药集团欧意药业有限公司和江苏恒瑞医药股份有限公司都获得优先审评的资质。江苏康禾生物制药有限公司2017年以新3类报产,预计申报的是未在国内上市的规格。
恒瑞报产的注射用替莫唑胺适应症为新诊断的多形性胶质母细胞瘤成人患者,以及用亚硝基脲和甲基苄肼常规治疗后复发或进展的间变性星形细胞瘤成人患者。恒瑞2015年曾以旧化学药分类3.3报产,止步于第一批床自查核查,本次以新3类再次报产。注射用替莫唑胺已完成临床的还有江苏奥赛康药业有限公司。替莫唑胺口服药2016年样本医院市场4.8亿元。
止步于第一批床自查核查再次报产的还有武汉大安制药有限公司首仿氟比洛芬酯注射液,原是第一家首仿报产,现在被重庆药友制药有限责任公司2016年“超车”申报而排到第二位。氟比洛芬酯注射液2016年样本医院市场6.2亿元。武汉大安制药有限公司产品如果能上市,将会改变目前北京泰德独家的格局。
新4类、旧6类:首仿依然是热点
新4类和旧6类的报产则以口服药为主。有抢首仿的,如阿哌沙班片、达沙替尼片、维格列汀片和来那度胺胶囊,正大天晴药业集团股份有限公司、四川科伦药业股份有限公司和江苏豪森药业股份有限公司在竞争阿哌沙班片,江苏豪森药业股份有限公司和齐鲁制药有限公司在抢仿维格列汀片,达沙替尼片2017年仅石药集团欧意药业有限公司申报,来那度胺胶囊的申报方仅正大天晴药业集团股份有限公司。
2016年CFDA批准的首仿药产品,2017年也有不少厂家加入竞争行列,如富马酸替诺福韦二吡呋酯片,安徽贝克生物制药有限公司和苏州特瑞药业有限公司申报。
进口药(新5.1类):13个报产
2017年,共13个国内未上市的进口新药报产(新化学药分类5.1类)。其中最快获批的当属阿斯利康的甲磺酸奥希替尼片,2月承办3月就获批了。
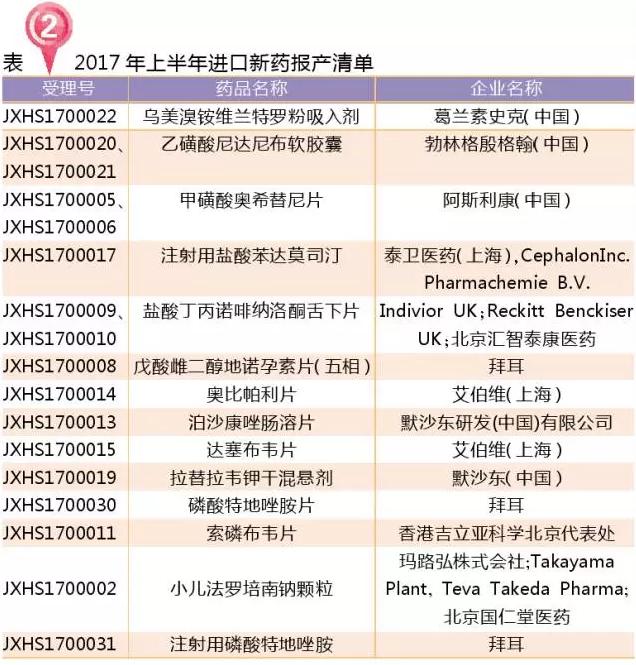
进口仿制药的报产(新化学药分类5.2类)以原料药为主,唯一的制剂申报是韩美的吸入用盐酸氨溴索溶液,这也是第一批临床自查核查撤回后的“回锅肉”,目前国内也仅韩美报产了。吸入用盐酸氨溴索溶液目前国内已启动临床的有瑞阳制药有限公司、云南龙海天然植物药业有限公司和吉林四环制药有限公司。
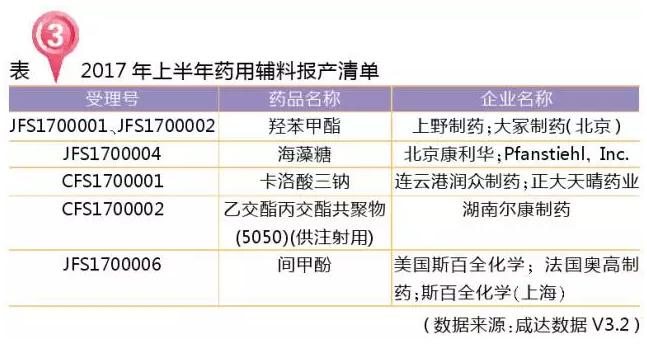
药用辅料报产有新的受理号模式,进口的前三位字母为“JFS”,国产的前三位字母为“CFS”,2017年上半年共5个药用辅料报产。
延伸>>>
临床申报1类新药占比最大
临床申报中,化学药1类新药占比最多,基本没有3类药申报。化学药1类新药申报方面,广东东阳光药业有限公司2017年申报受理号20个排名第一,分别是HEC30654AcOH及胶囊、HEC68498钠盐及胶囊、HEC74647PA及胶囊、康达瑞韦钠及片、利他匹仑及片。诺华排第二,申报号数10个,为CNP520、LIK066片和INC280片。江苏恒瑞受理号9个排第三,SHR7280及片、SHR8554及注射液、SHR9146及片。
小结<<<
从2017年申报的趋势可看出,国内新药项目热度提升,咸达数据V3.2发现广东东阳光、江苏恒瑞、石药集团、南京圣和、山东绿叶、广东众生、上海景峰、四川科伦、正大天晴等都在1类新药积极布局。报产方面,化学药抢首仿近期内仍是热点。
此外,一类临床申报获批的速度较快,基本2017年申报半年内就会有审批结果。